
Die vorliegende Dissertation ist in fünf thematisch unterschiedliche Teile untergliedert, die in sich geschlossen sind. Teil I befasst sich mit der Palladium-katalysierten asymmetrischen Fluorierung und Teil II mit der Palladium-katalysierten asymmetrischen Chlorierung von Isoxazolinonen sowie der Zugang zu hoch interessanten und wertvollen Verbindungsklassen über die reduktive Ringöffnung der chiralen Isoxazolinone. Im Teil III der vorliegenden Arbeit wurde eine asymmetrischen Allylierung von Pyrazolonen weiterentwickelt, sowie der erstmalige Zugang von β Aminoamiden über eine reduktive Ringöffnung der Pyrazolone erschlossen. Der Teil IV befasst sich mit einer Palladium-katalysierten asymmetrischen Meisenheimer-Umlagerung, die von Xin Yu entwickelt und in dieser Arbeit weiter ergänzt wurde. Teil V beschäftigt sich mit dem Konzept der „Cation Binding“ Katalyse und der Synthese diverser neuartiger Palladazyklen, sowie deren Anwendung in verschiedenen Reaktionstypen.
Aktualisiert: 2022-12-30
> findR *

Die vorliegende Dissertation befasst sich mit der chemischen Synthese terpenoider Naturstoffe und neuen aminofunktionalisierten Analoga, die gemäß einer Arbeit von Hergenrother als potentielle Breitband-Antibiotika von Interesse waren. Neben der Entwicklung geeigneter Methoden zur Aminofunktionalisierung phenolischer Verbindungen, die zunächst an den Mono- bzw. Sesquiterpenen Carvacrol, Xanthorrhizol sowie 7-Hydroxycalamenen erprobt wurden, wurde eine effiziente, enantioselektive Totalsynthese des Serrulatans 7-Hydroxyerogorgiaen sowie des Amphilectans 9-Desoxypseudopterosin Aglykon ausgearbeitet (8 bzw. 9 Stufen ausgehend von 3-Methoxy-4-methyl-styrol; 29% bzw. 30% Gesamtausbeute). Als C-C-verknüpfende Schlüsselschritte dienen hierbei eine Cobalt-katalysierte asymmetrische Hydrovinylierung, eine Pd-katalysierte Suzuki-Kreuzkupplung sowie diastereoselektive Lewis-Säure-vermittelte (kationische) Cyclisierungsreaktionen. Insgesamt wurden 15 neue Naturstoffderivate (Amine) hergestellt (z.T. als Mischung von Stereoisomeren), die dann bezüglich ihrer antibakteriellen Eigenschaften getestet wurden. Tatsächlich zeigten einige der Verbindungen eine sehr hohe Wirksamkeit, und zwar nicht nur gegen Gram-positive sondern insbesondere auch gegen Gram-negative Bakterienstämme. Hierdurch wurde die zugrundeliegende Arbeitshypothese eindeutig belegt.
Aktualisiert: 2022-12-30
> findR *

Die asymmetrische Katalyse stellt eine der besten Methoden zum Aufbau enantiomerenreiner Verbindungen dar. Als besonders effizient hat sich dabei das Konzept der kooperativen Katalyse herausgestellt. Hierbei werden mehrere funktionelle Gruppen innerhalb eines Katalysatormoleküls vereinigt, wodurch mehrfache definierte Wechselwirkungen mit den Substraten erfolgen können und somit eine hohe Stereokontrolle erreicht wird.
In dieser Arbeit wird die Anwendung solcher kooperativen Lewis-Säure/Oniumsalz-Katalysatoren in verschiedenen Cyanierungsreaktionen beschrieben. Hierbei wurde die erste hochenantioselektive Strecker-Reaktion von Aldiminen unter Einsatz von Acetoncyanhydrin entwickelt. Dabei dient dieses Reagenz sowohl als Cyanidquelle als auch als Protonenquelle, wodurch auf weitere stöchiometrische Additive verzichtet werden konnte. Über kinetische und mechanistische Studien wurde die Wirkungsweise des Katalysators aufgeklärt und ein Reaktionsmechanismus postuliert. Zudem wurde die essentielle Kooperation zwischen Lewis-Säure und Onium-Einheit aufgezeigt.
Aktualisiert: 2021-12-30
> findR *

Enzyme sind die polyfunktionelle Katalysatoren der Natur, welche für spezielle biochemische und synthetische Transformationen maßgeschneidert wurden, um diese mit nahezu perfekter Stereokontrolle auszuführen. Aus der Sicht des synthetischarbeitenden Chemikers limitiert jedoch die hohe Substratspezifität das Einsatzgebiet dieser Biokatalysatoren. Aufgrund dessen gelten künstlich erschaffene Katalysatoren, die sich durch ein breiteres Substrat- und Reaktionspektrum auszeichnen, als eine wichtige Alternative. In der asymmetrischen Synthese von Stereozentren wird häufig eine von Natur aus gegebene Präferenz in der Bildung von Diastereomeren beobachtet. Um einen Zugang zu allen Diastereomeren gewährleisten zu können, werden Katalysatorsysteme benötigt, die ein besonders hohes Maß an Stereokontrolle ausüben.
In dieser Arbeit wird die Entwicklung und Anwendung von polyfunktionellen, chiralen Katalysatoren beschrieben, welche enzymartige Aktivierungseigenschaften innerhalb eines Katalysatormoleküls vereinen. Diese neuartigen Katalysatoren kombinieren ein Lewis-saures Metallzentrum mit einem Brønsted-basischem Imidazolium-Aryloxid-Betain-Rest. Dieses Konzept ermöglichte erstmals die seletive Synthese einer bisher nicht zugänglichen Diastereomerenkonfiguration in der 1,4-Addition von β-Ketoestern an Nitroolefine. Zusätzlich ermöglichte die Systeme die selektive Umsetzung von α,β-disubstituierten Nitroolefinen, wobei ein drittes benachbartes Stereozentrum hochselektiv gebildet wurde. Hierfür spielt die quasi-intramolekulare, diastereoselektive Protonierung eine maßgebende Rolle. Detaillierte spektroskopische und kinetische Studien (RPKA und VTNA), als auch DFT-Rechnungen unterstützen den postulierten Mechanismus und zeigen, dass die C-C-Bindungsknüpfung, die Protonierung des Additionsproduktes oder deren Kombination der geschwindigkeitsbestimmende Schritt der Reaktion ist. Der robuste Katalysator ist leicht zugänglich, rezyklierbar und besitzt ein breites Substratspektrum.
Aktualisiert: 2021-12-30
> findR *
Christoph Schlepphorst entwickelt ein rationales Ligandendesign für die Ruthenium-NHC-katalysierte asymmetrische Hydrierung (hetero-)aromatischer Verbindungen. Zudem synthetisiert er eine Reihe von entsprechenden Carbenvorläufern und charakterisiert diese. Die synthetisierten Carbenvorläufer werden außerdem auf ihre Eignung als Liganden in Ru-NHC-katalysierten Hydrierreaktionen getestet. Der Autor optimiert bei diesem Vorgehen die asymmetrische Hydrierung ungeschützter monosubstituierter Pyrazine im Hinblick auf die Reaktionsbedingungen und kann Enantiomerenverhältnisse von bis zu 91:9 mit einem der neuen Liganden erreichen.
Aktualisiert: 2023-03-14
> findR *

In dieser Arbeit werden die ersten strukturell definierten, chiralen, kooperativen Katalysatoren, welche auf einer relativ stabilen Al-F-Bindung basieren, vorgestellt. Diese erwiesen sich als außergewöhnlich robust und stellten sich als monatelang an Luft lagerbar, relativ stabil gegenüber Feuchtigkeit sowie Temperaturen bis über 220 °C heraus und zeigten auch eine gewisse Robustheit gegenüber protischen Lösungsmitteln. In der Carboxycyanierung von Aldehyden mit Ethylcyanoformiat konnten 37 Substrate mit Enantioselektivitäten bis 97% ee bei einer Standard-Katalysatorladung von lediglich 0.1 mol% umgesetzt werden. Darüber hinaus wird ein Cyanocyarboxylierungsprotokoll vorgestellt, welches dank der Phasentransferfähigkeiten der Katalysatoren ausschließlich preiswertes und relativ einfach handhabbares Kaliumcyanid nutzt. Die Katalysatorsysteme wurden zudem in anderen Transformationen wie Trifluormethylierungen, 1,2-Additionen von Azid- und Thiocyanatanionen an Aldehyde, Alkylierungen von Aldehyden, Darzens-Reaktionen, Epoxidöffnungen mit Cyanidanionen und Strecker-Reaktionen untersucht.
Aktualisiert: 2019-12-27
> findR *

Diese Arbeit beschäftigt sich mit der Synthese chiraler Betti-Basen und davon abgeleiteten Phosphorliganden. Dabei wird das Strukturmotiv des bereits bekannten Bettiphos-Liganden aufgegriffen und an verschiedenen Stellen modifiziert. Auf diese Weise werden neuartige bidentate Phosphin-Phosphorodiamidite sowie monodentate Phosphorodiamidite und Phosphoramidite dargestellt und so die Ligandenfamilie des Bettiphos-Liganden erweitert. Insbesondere wird hierbei der Einfluss der variierten Strukturelemente auf die Konfiguration des während der Synthese neu gebildeten Stereozentrums am Phosphoratom untersucht. Anschließend erfolgt die Anwendung der dargestellten Liganden in der asymmetrischen Katalyse. Zunächst werden die bidentaten Phosphin-Phosphorodiamidit-Liganden in der asymmetrischen Hydroformylierung getestet. Weiterhin werden die Liganden in der asymmetrischen Hydroaminomethylierung eingesetzt. Hierbei handelt es sich um eine Reaktionskaskade aus Hydroformylierung, Kondensation des Aldehyds mit einem Amin und anschließender Hydrierung des Imins oder Enamins. Die asymmetrische Hydrierung β-funktionalisierter Enamine stellt dabei den enantiodiskriminierenden Schritt dar, weswegen sie separat untersucht wird. Hier werden neben den Phosphin-Phosphorodiamiditen ebenfalls die monodentaten Phosphorodiamidite und Phosphoramidite eingesetzt. Zusätzlich wird das Ligandenscreening auf kommerziell erhältliche chirale Phosphorliganden ausgeweitet. In der asymmetrischen Hydroaminomethylierung von Vinylestern wurden als Nebenprodukte α-Amidoketone beobachtet. Deren gezielte Darstellung wird ebenfalls genauer untersucht.
Aktualisiert: 2020-01-15
> findR *
Christoph Schlepphorst entwickelt ein rationales Ligandendesign für die Ruthenium-NHC-katalysierte asymmetrische Hydrierung (hetero-)aromatischer Verbindungen. Zudem synthetisiert er eine Reihe von entsprechenden Carbenvorläufern und charakterisiert diese. Die synthetisierten Carbenvorläufer werden außerdem auf ihre Eignung als Liganden in Ru-NHC-katalysierten Hydrierreaktionen getestet. Der Autor optimiert bei diesem Vorgehen die asymmetrische Hydrierung ungeschützter monosubstituierter Pyrazine im Hinblick auf die Reaktionsbedingungen und kann Enantiomerenverhältnisse von bis zu 91:9 mit einem der neuen Liganden erreichen.
Aktualisiert: 2023-04-04
> findR *
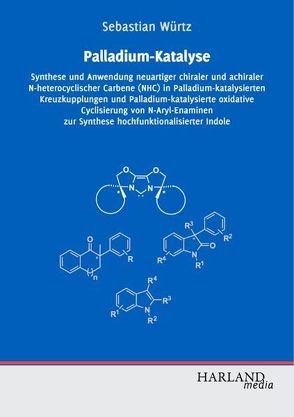
Palladium-katalysierte C-C-Bindungsknüpfungen gehören zu den wichtigsten Reaktionen zur Synthese komplexer organischer Verbindungen. Durch die stetige Weiterentwicklung immer aktiverer Katalysatorsysteme werden Kreuzkupplungen reaktionsträger Substrate unter milden Reaktionsbedingungen ermöglicht.
Sebastian Würtz beschreibt die effiziente Synthese neuartiger chiraler und achiraler Bioxazolin-abgeleiteter Carbenvorläufer (IBiox) als Liganden für Palladium-Katalysatoren. So kann ausgehend von kommerziell erhältlichem (-)-Menthon in wenigen Schritten ein außergewöhnlich sterisch anspruchsvoller, chiraler IBiox-Ligand dargestellt werden. Der korrespondierende Palladium-Komplex ist ein sehr effizienter Katalysator für die asymmetrische intramolekulare alpha-Arylierung zur Synthese von Oxindolen mit bemerkenswert hohen Enantiomerenüberschüssen.
Die Übergangsmetall-katalysierte C-H-Aktivierung unter Knüpfung von neuen C-C-Bindungen erlaubt die direkte Umsetzung unfunktionalisierter Substrate. Diese noch relativ junge Methode stellt eine attraktive Alternative zu den klassischen Kreuzkupplungsreaktionen dar. Sebastian Würtz beschreibt eine neuartige Synthese hochfunktionalisierter Indole, die ausgehend von N-Arylenaminen unter Aktivierung zweier C-H-Bindungen durch Palladium-Katalyse gebildet werden können.
Die gezeigten Ergebnisse können als Inspiration für weitere Entwicklungen im Bereich der Katalysatorforschung mit Blick auf herausfordernde Kreuzkupplungsreaktionen dienen.
Aktualisiert: 2020-06-01
> findR *
Diese Dissertation beschäftigt sich mit der Verwendung von bidentaten tropos-Liganden (tropos (griech.) = drehen), welche durch Kombination mit chiralen Additiven für Anwendungen in der asymmetrischen Übergangsmetall-Katalyse nutzbar gemacht werden. Hierzu zählen insbesondere bidentate Phosphin-Liganden wie tropos-BIPHEP, welche u.a. mit Prolin-basierten ionischen Flüssigkeiten kombiniert werden. Darüber hinaus werden Synthesen neuer 5,5'-disubstituierte tropos-BIPHEP Derivate vorgestellt, welche zusätzliche Wechselwirkungsmöglichkeiten aufweisen. Durch Kenntnis und Kontrolle der Reaktionsbedingungen bei der Katalysatorkomplexierung lässt sich die Selektivität einer Reaktion steuern. Das Potential so kontrollierter Katalysatorsysteme wird in der asymmetrischen Hydrierung von C-C-Doppelbindungen und bei asymmetrischen Hydroborierungen vorgestellt.
Aktualisiert: 2019-12-12
> findR *
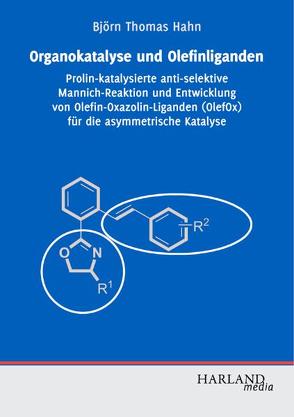
Die asymmetrische Katalyse ist eine wichtige Technologie, um moderne Wirkstoffe effizient herzustellen. Organokatalytische und Metall-katalysierte Reaktionen stellen hierbei die wichtigsten Bereiche der homogenen Katalyse dar.
Björn Hahn stellt die anti-selektive Prolin-katalysierte Mannichreaktion zur hochenantiomerenreinen Darstellung von alpha-Aminosäuren vor. Durch wohldurchdachte Gestaltung der Substrate ist es gelungen, die Selektivität zugunsten des sonst unzugänglichen Diastereomers zu beeinflussen. Durch milde hydrogenolytische C-N-Bindungsspaltung werden die freien Aminosäuren erhalten.
Olefine als Liganden für Übergangsmetalle werden in vielen katalytischen Reaktionen erfolgreich eingesetzt. Durch die Kombination von olefinischer Doppelbindung und Oxazolin in einem Ligandensystem lassen sich die elektronischen und sterischen Eigenschaften der katalytisch aktiven Spezies individuell einstellen. Björn Hahn beschreibt die Entwicklung und Anwendung von Olefin-Oxazolin-Liganden. Mehrere hochmodulare Syntheserouten werden vorgestellt und die Vielseitigkeit der Liganden in einigen enantioselektiven Reaktionen demonstriert.
Dieses Buch richtet sich an Leser aus der synthetischen organischen Chemie und aus dem Bereich der enantioselektiven Katalyse.
Aktualisiert: 2020-06-01
> findR *
MEHR ANZEIGEN
Bücher zum Thema asymmetrische Katalyse
Sie suchen ein Buch über asymmetrische Katalyse? Bei Buch findr finden Sie eine große Auswahl Bücher zum
Thema asymmetrische Katalyse. Entdecken Sie neue Bücher oder Klassiker für Sie selbst oder zum Verschenken. Buch findr
hat zahlreiche Bücher zum Thema asymmetrische Katalyse im Sortiment. Nehmen Sie sich Zeit zum Stöbern und finden Sie das
passende Buch für Ihr Lesevergnügen. Stöbern Sie durch unser Angebot und finden Sie aus unserer großen Auswahl das
Buch, das Ihnen zusagt. Bei Buch findr finden Sie Romane, Ratgeber, wissenschaftliche und populärwissenschaftliche
Bücher uvm. Bestellen Sie Ihr Buch zum Thema asymmetrische Katalyse einfach online und lassen Sie es sich bequem nach
Hause schicken. Wir wünschen Ihnen schöne und entspannte Lesemomente mit Ihrem Buch.
asymmetrische Katalyse - Große Auswahl Bücher bei Buch findr
Bei uns finden Sie Bücher beliebter Autoren, Neuerscheinungen, Bestseller genauso wie alte Schätze. Bücher zum
Thema asymmetrische Katalyse, die Ihre Fantasie anregen und Bücher, die Sie weiterbilden und Ihnen wissenschaftliche
Fakten vermitteln. Ganz nach Ihrem Geschmack ist das passende Buch für Sie dabei. Finden Sie eine große Auswahl
Bücher verschiedenster Genres, Verlage, Autoren bei Buchfindr:
Sie haben viele Möglichkeiten bei Buch findr die passenden Bücher für Ihr Lesevergnügen zu entdecken. Nutzen Sie
unsere Suchfunktionen, um zu stöbern und für Sie interessante Bücher in den unterschiedlichen Genres und Kategorien
zu finden. Unter asymmetrische Katalyse und weitere Themen und Kategorien finden Sie schnell und einfach eine Auflistung
thematisch passender Bücher. Probieren Sie es aus, legen Sie jetzt los! Ihrem Lesevergnügen steht nichts im Wege.
Nutzen Sie die Vorteile Ihre Bücher online zu kaufen und bekommen Sie die bestellten Bücher schnell und bequem
zugestellt. Nehmen Sie sich die Zeit, online die Bücher Ihrer Wahl anzulesen, Buchempfehlungen und Rezensionen zu
studieren, Informationen zu Autoren zu lesen. Viel Spaß beim Lesen wünscht Ihnen das Team von Buchfindr.










