EU-GMP-Leitfaden Teil I
aus der Reihe "GMP-Regularien" (E-Book)
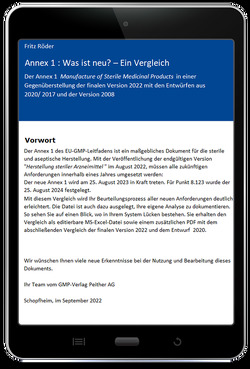
Arzneimittelqualität ist kein Zufallsprodukt sondern das Ergebnis sorgfältig geplanter und durchgeführter Prozesse. Der EU-GMP-Leitfaden legt für Deutschland, die Schweiz und alle EU-Mitgliedsstaaten allgemein gültige GMP-Grundsätze für die Herstellung von Arzneimitteln fest. Wer in diesen Ländern Arzneimittel herstellt oder dorthin importiert, muss die darin enthaltenen Forderungen genau kennen und konsequent einhalten.
In kompakter und zweisprachiger Form enthält dieser Band den vollständigen Teil I des EU-GMP-Leitfadens:
– Kapitel 1 Pharmazeutisches Qualitätssystem
– Kapitel 2 Personal
– Kapitel 3 Räumlichkeiten und Ausrüstung
– Kapitel 4 Dokumentation
– Kapitel 5 Produktion
– Kapitel 6 Qualitätskontrolle
– Kapitel 7 Ausgelagerte Tätigkeiten
– Kapitel 8 Beanstandungen, Qualitätsmängel und Produktrückrufe
– Kapitel 9 Selbstinspektion
englisch / deutsch
mit Stichwortverzeichnis!