Peptido RNAs are 5'-phosphorylated oligoribonucleotides connected to the a-amino group of a peptide via a phosphoramidate linkage. Previously, peptido RNAs with statistical chain length distributions could be detected as products of spontaneous reactions between amino acids and ribonucleotides in an aqueous condensation buffer. Although occupying a niche role in today’s biochemistry, the formation of peptido RNAs as possible intermediate evolutionary species may be important in relation to the molecular origin of life. To enable in- depth biophysical studies of these modified RNAs, synthetic protocols for obtaining monodisperse, pure compounds are described in this dissertation.
Aktualisiert: 2021-12-30
> findR *

Die vorliegende Arbeit befasst sich mit der Entwicklung und Anwendung von organokatalytischen enantioselektiven Reaktionen, die einen Zugang zu wertvollen komplexen chiralen Molekülen bieten. Hierzu wurden unterschiedliche organokatalytische Aktivierungsformen an diversen Substraten untersucht und bezüglich der Reaktivität und Selektivität evaluiert. Weiterhin wurde das Design der verwendeten Katalysatoren in den neu entwickelten Reaktionen studiert und diskutiert. Explizit wurde in den drei folgenden Gebieten der asymmetrischen Organokatalyse geforscht: Enantioselektive Lewis-Base-Katalyse mittels Prolinolethern, die biomimetisch der Typ I Aldolase A nach, eine Iminium/Enamin-Aktivierung vollziehen; Enantioselektive bifunktionale Organokatalyse unter Verwendung von Cinchona-basierenden Thioharnstoffen, wobei die Thioharnstoff-Einheit als HBrücken-Donor und das Cinchona-Alkaloid als chirale Brønsted-Base die Substrate aktivieren; Enantioselektive Brønsted-Säure-Katalyse unter Verwendung von stark aciden N-Triflylphosphoramiden mit einer BINOL-Einheit als chiralem Baustein.
Bei der Verwendung von Prolinolethern 22, deren Eigenschaft es ist, Elektrophile als
auch Nukleophile durch Iminium- bzw. Enamin-Bildung zu aktivieren, konnte eine
neuartige enantioselektive Domino-Michael-Aldol-Reaktion entwickelt werden (Abbildung 1). Hierbei wurden aus den kommerziell erwerblichen Edukten 90 und 14
komplexe Bicyclo[3.2.1]octancarbaldehyde 91 aufgebaut. Die Produkte 91 wurden
ausschließlich als einzelnes Diastereomer bei einer Stereokontrolle von vier
stereogenen Zentren in guten Ausbeuten und mit exzellenten Enantioselektivitäten
(90-98% ee) erhalten. Die Bicyclen 91 lassen sich effektiv zu synthetisch wertvollen
Verbindungen transformieren und bieten einen Zugang zu chiralen Cycloheptanonen
95, Tetrahydrochromenonen 96 und polyfunktionalisierten Bicyclo[3.2.1]octanen 98a
und 99.
Aktualisiert: 2019-03-15
> findR *

Die Erforschung und Erschließung neuartiger pharmakologisch relevanter Strukturelemente spielt für die moderne Wirkstoffforschung eine bedeutende Rolle. Im Rahmen der vorliegenden Dissertation wurden stereoselektive Synthesemethoden für Stickstoffheterocyclen -- Hydroindole, Bisindole und Thiodiketopiperazine -- erarbeitet.
Im ersten Teil der Arbeit wurde eine stereoselektive Synthese hochfunktionalisierter Hydroindole entwickelt, welche für eine Totalsynthese des cytotoxischen Mykotoxins Rostratin C verwendet werden können. Zudem konnte ein komplexes Diketopiperazin durch Dimerisierung zweier Hydroindoleinheiten synthetisiert werden, welches bereits das vollständig funktionalisierte Rostratin C-Gerüst darstellt. Im Rahmen dieser Synthesen wurde zudem eine neuartige, metallfreie Perfluoralkylierungsreaktion entwickelt.
Im zweiten Teil der Arbeit wurde die Einführung von Schwefeleinheiten in Diketopiperazine anhand von Modellsystemen untersucht. Es konnten zwölf neue Thiodiketopiperazine hergestellt werden. Einige der Verbindungen zeigten die Generierung reaktiver Sauerstoffspezies in HeLa-Zellen auf.
Der dritte Teil der Arbeit beschäftigt sich mit der asymmetrischen organokatalytischen Synthese neuartiger Bisindole. Ausgehend von Vinylindolen und Iminoestern konnten 13 Bisindol-Derivate in guten Ausbeuten und exzellenten Enantiomerenüberschüssen dargestellt werden.
Aktualisiert: 2022-12-21
> findR *
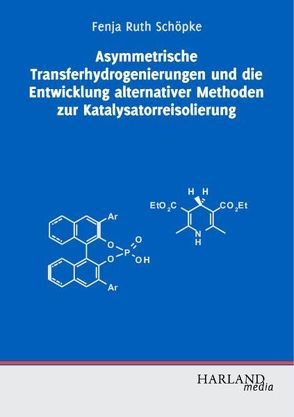
Asymmetrische Katalyse ist eine der bedeutendsten Methoden, um chirale Moleküle, die insbesondere in der pharmazeutischen Forschung von hohem Interesse sind, herzustellen.
Fenja Schöpke zeigt Methoden metallfrei, unter milden Bedingungen, eine Vielzahl verschiedener chiraler Stickstoffheterozyklen in sehr guten Ausbeuten und Enantiomerenüberschüssen herzustellen. Die beschriebenen Konzepte beruhen dabei auf der Verwendung von chiralen BINOL-Phosphaten als Katalysatoren sowie Hantzsch-Estern als Hydridquelle.
Des Weiteren zeigt Fenja Schöpke neue Konzepte zur Katalysator##e#Reisolierung. So wird die Immobilisierung von Diarylprolinolethern an Polystyrol-basierten Polymersticks vorgestellt, die es ermöglichen den Katalysator wie einen Teebeutel der Reaktionslösung zu entnehmen. Weiterhin wird die Reisolierung von BINOLen und BINOL-Phosphaten über Adsorption an Kohlenstoffnanoröhren sowie über Abtrennung durch Nanofiltration beschrieben.
Dieses Buch richtet sich an Leser der organischen Synthese sowie asymmetrischen Katalyse und bietet eine Grundlage für weitere Forschungstätigkeiten auf diesen Gebieten.
Aktualisiert: 2020-06-01
> findR *

Die Chemikerin Yvonne Gnas stellt in diesem Buch verschiedene Aspekte der asymmetrischen Synthese in der organischen Chemie dar.
Zunächst untersucht Sie diastereoselektive Hydrierungen verschiedener N-Heterocyclen. Neben Pyrazinen und Pyrrolen wird auch die heterogene Reduktion von Pyridinen thematisiert und genauer bewertet. Die Autorin befasst sich zudem mit der Synthese chiraler Metallkomplexe durch Selbstorganisation. Die verwendeten Liganden bilden sich erst in Reaktion mit dem Metallsalz und erlauben eine leichte Variation der Komplexe. Ferner betrachtet sie die Synthese eines chiralen Diborats, das beispielsweise zur Durchführung von asymmetrischen organokatalytischen Reaktionen eingesetzt werden konnte. Genauer untersucht wurde dabei der Unterschied zu den bislang meist verwendeten Monoanionen.
Das Buch von Yvonne Gnas richtet sich besonders an Chemiker mit einem tiefer gehenden Interesse für asymmetrische Katalyse. Darüber hinaus liefert es einen guten Überblick über heterogene Hydrierungen und asymmetrische Organokatalyse.
Aktualisiert: 2020-06-01
> findR *

In der vorliegenden Dissertation wurde die Synthese chiraler Strukturmotive biologischer und pharmakologischer Relevanz mit katalytischen Verfahren realisiert. Es wurden Fragestellungen der homogenen und heterogenen Katalyse bearbeitet, welche sich in die drei folgenden großen Themenbereiche unterteilen lassen. Erstens: enantioselektive homogene Hydrierungen von Benzodiazepinonen sowie von Indoleninen unter Einsatz eines chiralen Rhodium- bzw. Iridium-Bisphosphan Katalysators. Zweitens: heterogene Hydrierungen selbiger Substrate mit einem neu entwickelten Hybridkatalysator, bestehend aus auf Kohlenstoffnanoröhren immobilisierten Iridium-Nanopartikeln (Ir-NP@CNT). Drittens: die Entwicklung funktionalisierter Polymer-Katalysatoren, die aufgrund ihrer thermoresponsiven Eigenschaften eine reversible Temperatur-Schaltbarkeit aufweisen und so die Vorteile homogener Katalysatoren unter Reaktionsbedingungen mit der Recyclierbarkeit heterogener Spezies vereinen. Das Konzept wurde sowohl auf heterogene Metallnanopartikel- Katalysatoren als auch auf homogene Metall-Ligand-Komplexe sowie Organokatalysatoren übertragen und in Hydrierungen,Kreuzkupplungsreaktionen sowie der Desymmetrisierung zyklischer meso-Anhydride angewendet.
Aktualisiert: 2022-02-04
> findR *
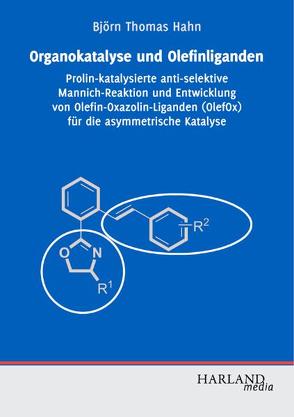
Die asymmetrische Katalyse ist eine wichtige Technologie, um moderne Wirkstoffe effizient herzustellen. Organokatalytische und Metall-katalysierte Reaktionen stellen hierbei die wichtigsten Bereiche der homogenen Katalyse dar.
Björn Hahn stellt die anti-selektive Prolin-katalysierte Mannichreaktion zur hochenantiomerenreinen Darstellung von alpha-Aminosäuren vor. Durch wohldurchdachte Gestaltung der Substrate ist es gelungen, die Selektivität zugunsten des sonst unzugänglichen Diastereomers zu beeinflussen. Durch milde hydrogenolytische C-N-Bindungsspaltung werden die freien Aminosäuren erhalten.
Olefine als Liganden für Übergangsmetalle werden in vielen katalytischen Reaktionen erfolgreich eingesetzt. Durch die Kombination von olefinischer Doppelbindung und Oxazolin in einem Ligandensystem lassen sich die elektronischen und sterischen Eigenschaften der katalytisch aktiven Spezies individuell einstellen. Björn Hahn beschreibt die Entwicklung und Anwendung von Olefin-Oxazolin-Liganden. Mehrere hochmodulare Syntheserouten werden vorgestellt und die Vielseitigkeit der Liganden in einigen enantioselektiven Reaktionen demonstriert.
Dieses Buch richtet sich an Leser aus der synthetischen organischen Chemie und aus dem Bereich der enantioselektiven Katalyse.
Aktualisiert: 2020-06-01
> findR *

Eine Vielzahl komplexer Natur- und Wirkstoffe sind chirale Moleküle, die eine oder mehrere stereogene Zentren besitzen. Eine Voraussetzung für ein chirales Molekül ist die fehlende Drehspiegelachse Sn, so dass Bild- und Spiegelbild des Moleküls nicht deckungsgleich sind. Zur Unterscheidung werden die beiden möglichen Moleküle als Enantiomere bezeichnet. Mit Ausnahme der Drehrichtung linear polarisierten Lichts, besitzen die Enantiomere in einer nicht chiralen Umgebung die gleichen physikalischen Eigenschaften. Allerdings kann die Wechselwirkung beispielsweise zwischen Enantiomeren und chiralen Rezeptoren im menschlichen Organismus sehr unterschiedlich sein. Aus diesem Grund sind enantiomerenreine Substanzen in der Agrochemie, Pharma-, Lebensmittel- und Aromastoffindustrie besonders von Bedeutung. Verschiedene Methoden haben sich für die Gewinnung enantiomerenreiner Verbindungen etabliert. Eine einfache Möglichkeit ist die Synthese beider Enantiomere mit anschließender Trennung. Die sogenannte Racematspaltung erlaubt eine maximale Ausbeute von 50%. Zudem bietet der „Chiral Pool“ mit enantiomerenreinen Naturstoffen eine Basis für vielfältige Synthesebausteine, deren vordefinierte Stereozentren in die gewünschten Produkte eingebaut werden können. Die wichtigste und eleganteste Möglichkeit ist die gezielte stereoselektive Darstellung von chiralen Molekülen mittels asymmetrischer Synthese. Ziel dieser Variante ist die Herstellung der Enantiomere in ungleichen Mengenverhältnissen, beziehungsweise die ausschließliche Bildung des bevorzugten Enantiomers. Voraussetzung hierzu ist, dass sich eine prochirale Verbindung während der Transformation zum Zielmolekül in einer chiralen Umgebung befindet. Die Übertragung der Chiralitätsinformation auf ein Substrat kann dabei auf verschiedenen Wegen erfolgen. Die asymmetrische Synthese lässt sich in weitere Teilgebiete unterteilen, die sich durch den Einsatz chiraler Auxiliare, Enzyme, Metall-oder Organokatalysatoren unterscheidenlassen. Chirale Auxiliare sind Hilfsstoffe, die sich stöchiometrisch an das Substrat binden und die Folgereaktion stereochemisch beeinflussen. Ein wichtiger Vertreter der Auxiliare ist die von Enders und Mitarbeitern entwickelte SAMP/RAMP-Hydrazon-Methode. In mehrstufigen Synthesen wurden die Auxiliare aus den Aminosäuren (S)-Prolin für SAMP beziehungsweise (R)-Glutaminsäure für RAMP hergestellt. Gemäß der Abbildung 1 wurden in vielen bekannten Naturstoffsynthesen mit Hilfe dieser Auxiliare Ketone und Aldehyde 1 in die entsprechenden chiralen Hydrazone 2 überführt und im Anschluss in α-Stellung asymmetrisch zu den Produkten 3 alkyliert.
Aktualisiert: 2020-01-13
> findR *
MEHR ANZEIGEN
Bücher zum Thema Organokatalyse
Sie suchen ein Buch über Organokatalyse? Bei Buch findr finden Sie eine große Auswahl Bücher zum
Thema Organokatalyse. Entdecken Sie neue Bücher oder Klassiker für Sie selbst oder zum Verschenken. Buch findr
hat zahlreiche Bücher zum Thema Organokatalyse im Sortiment. Nehmen Sie sich Zeit zum Stöbern und finden Sie das
passende Buch für Ihr Lesevergnügen. Stöbern Sie durch unser Angebot und finden Sie aus unserer großen Auswahl das
Buch, das Ihnen zusagt. Bei Buch findr finden Sie Romane, Ratgeber, wissenschaftliche und populärwissenschaftliche
Bücher uvm. Bestellen Sie Ihr Buch zum Thema Organokatalyse einfach online und lassen Sie es sich bequem nach
Hause schicken. Wir wünschen Ihnen schöne und entspannte Lesemomente mit Ihrem Buch.
Organokatalyse - Große Auswahl Bücher bei Buch findr
Bei uns finden Sie Bücher beliebter Autoren, Neuerscheinungen, Bestseller genauso wie alte Schätze. Bücher zum
Thema Organokatalyse, die Ihre Fantasie anregen und Bücher, die Sie weiterbilden und Ihnen wissenschaftliche
Fakten vermitteln. Ganz nach Ihrem Geschmack ist das passende Buch für Sie dabei. Finden Sie eine große Auswahl
Bücher verschiedenster Genres, Verlage, Autoren bei Buchfindr:
Sie haben viele Möglichkeiten bei Buch findr die passenden Bücher für Ihr Lesevergnügen zu entdecken. Nutzen Sie
unsere Suchfunktionen, um zu stöbern und für Sie interessante Bücher in den unterschiedlichen Genres und Kategorien
zu finden. Unter Organokatalyse und weitere Themen und Kategorien finden Sie schnell und einfach eine Auflistung
thematisch passender Bücher. Probieren Sie es aus, legen Sie jetzt los! Ihrem Lesevergnügen steht nichts im Wege.
Nutzen Sie die Vorteile Ihre Bücher online zu kaufen und bekommen Sie die bestellten Bücher schnell und bequem
zugestellt. Nehmen Sie sich die Zeit, online die Bücher Ihrer Wahl anzulesen, Buchempfehlungen und Rezensionen zu
studieren, Informationen zu Autoren zu lesen. Viel Spaß beim Lesen wünscht Ihnen das Team von Buchfindr.







